Un team di ricercatori italiani ha rivelato un meccanismo nascosto che agisce già durante la formazione delle proteine. Una scoperta che potrebbe cambiare la ricerca sui tumori
Ogni secondo, gli organismi viventi producono milioni di proteine.
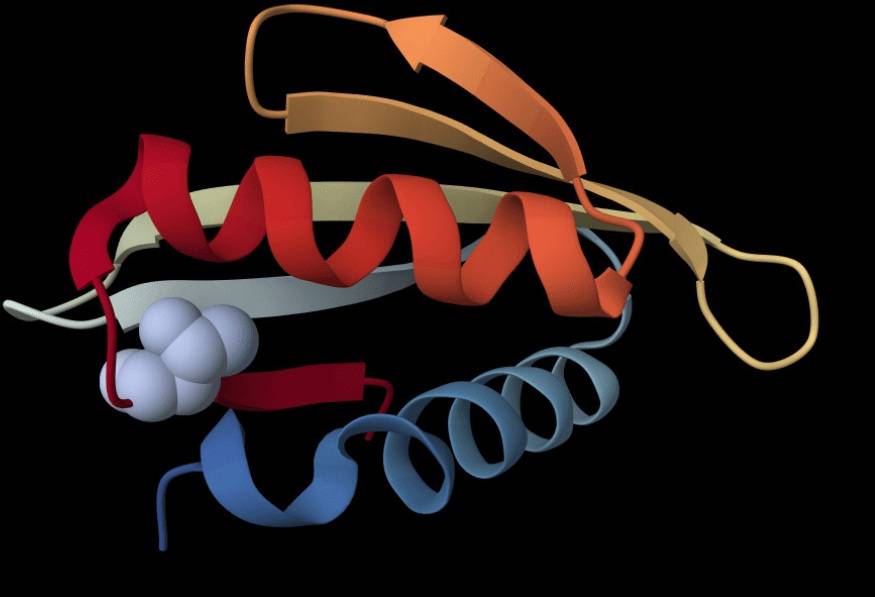
Queste “nanomacchine” fondamentali, composte da catene di diversi amminoacidi, devono acquisire però una forma specifica attraverso una procedura descrivibile come un ripiegamento delle catene su sé stesse.
Una fase, che deve però portare al finale giusto, altrimenti le proteine non risultano in grado di svolgere al meglio la loro funzione biologica. In questo caso, le cellule possono intervenire sfruttando la loro capacità di modificare la struttura chimica delle proteine ripiegate. A differenza di quanto ritenuto finora, queste modifiche non sono possibili solo quando le proteine hanno assunto la loro forma finale, ma anche durante la fase di ripiegamento, con quella che si potrebbe definire una sorta di “controllo qualità” La scoperta, effettuata da un team di ricercatori coordinati dal biochimico Emiliano Biasini dell’Università di Trento e dall’esperto di biofisica computazionale Pietro Faccioli di Milano-Bicocca e contenuta in uno studio pubblicato su “Embo Journal”, apre la strada a nuovi filoni di ricerca, per provare a capire come queste modifiche anticipate possano influenzare la salute e contribuire all’insorgenza e allo sviluppo di alcune malattie, tra cui il cancro.
Gli errori nascosti nelle cellule
Nella biologia classica, le modifiche della struttura chimica delle proteine per innescare specifici processi biochimici avvengono dopo la loro produzione attraverso l’azione di enzimi su punti specifici accessibili della loro superficie, in particolare attraverso la modifica chimica di regolazione dell’attività delle proteine chiamata fosforilazione. Lo studio è partito dall’approccio innovativo, sviluppato pochi anni fa dagli stessi scienziati, che ha consentito di realizzare farmaci in grado di bloccare la formazione di proteine patogene, rendendole bersaglio di piccole molecole in grado di degradarle già nel corso del processo di ripiegamento. L’intuizione da verificare è stata quindi quella secondo cui, se è possibile interrompere il ripiegamento in laboratorio, è lecito pensare che la natura stessa disponga di strategie in grado di compiere un’azione analoga.

I ricercatori hanno così scoperto che in circa 1 proteina umana su 3 esistono siti di fosforilazione completamente nascosti all’interno della struttura della proteina e quindi inaccessibili agli enzimi, supportando l’ipotesi che, in caso di errori del processo di sintesi, le modifiche avvengano prima della fine del ripiegamento, destabilizzando le strutture e innescando e accelerando la degradazione proteica. “Se una proteina impiega troppo tempo per ripiegarsi – spiega Faccioli – la cellula può interpretare il ritardo come un segnale di malfunzionamento e “taggarla” con una fosforilazione, decidendo se mantenerla attiva o se eliminarla”.
I “fosfositi criptici” e il cancro
Attraverso simulazioni al calcolatore è stato osservato che il processo di ripiegamento di queste proteine si ferma temporaneamente in stati intermedi: una sorta di “stazione di sosta” che consente agli enzimi di intervenire per apportare le modifiche chimiche anticipate. Un risultato che è stato confermato anche attraverso esperimenti biochimici basati su proteine modificate geneticamente per mimare l’effetto della fosforilazione. Questi siti di mutazione nascosti all’interno dei nuclei proteici, chiamati “fosfositi criptici”, sono inoltre risultati più conservati rispetto ai residui fosforilati esposti in superficie. Un ulteriore confronto è stato quindi effettuato con i database delle mutazioni tumorali, trovando che alcune mutazioni che imitano la fosforilazione negli stessi siti criptici possono favorire lo sviluppo di un tumore, per esempio disattivando i geni oncosoppressori, che normalmente bloccano il cancro. La scoperta potrebbe dunque aiutare la comprensione dei meccanismi che portano a diverse malattie umane, a partire dai tumori.
Alberto Minazzi